PRACTICA 14: RUBEOLA IgG ELISA
21.01.2020
Componentes del kit
Componentes del kit
- Micro tiras (pocillos de microtiter) de IgG recubiertas de Ag de rubeola.
- Calibradores A-E (suero humano diluido con PBS: 0-10-50-200-500. Listos para usar.
- Conjugado de IgG antihumana. 15 mL y son Ac IgG antihumano de conejo. Listo para usar.
- Sustrato listo para usar.
- Solución de parada lista para usar.
- Solución diluyente para la muestra lista para usar.
- Solución de lavado. 10x. (1 de solución de lavado y 9 de agua destilada)
Muestra: suero o plasma. Hay que diluirla con el diluyente y la dilución es 1:101. (1 de muestra, 500 de diluyente)
PROCEDIMIENTO
Preparación de los reactivos:
Solo el de la solución de lavado que se diluye antes de usar al 1/9 con agua destilada. Para ello echamos 40 mL de solución de lavado en una probeta y luego enrasamos hasta 400 mL con agua destilada, agitamos con una varilla y luego lo repartimos en tubos Falcon para distintos grupos de clase.
Técnica
1. Preparar un pocillo para sustrato blanco. Se pone al principio o al final.
2. Se prepara pocillos para calibradores.
3. Pocillos para las muestras.
4. Pipetear 100 µL en cada pocillo de calibradores. Se deja el primer pocillo vacío para el blanco del sustrato
5. Pipetear 100 µL de muestra diluida en el pocillo 7. Previamente se diluyó la muestra al 1/10
6. Tapar e incubar 1 hora a temperatura ambiente.
7. Tras incubar aspirar o volcar el líquido de la tira y lavalos 3 veces con 300 uL de solución de lavado.
NOTA: es la fase más importante de la técnica porque un mal lavado da falsos positivos. Evitar rebosar los pocillos. Al acabar darle unos golpes en el papel absorbente.
8. Pipetear 100 uL de conjugado anti IgG con excepción del blanco.
9. Tapar e incubar 30 minutos a temperatura ambiente.
10. Repetir paso 7.
11. Pipetear 100 uL de sustrato en todos los pocillos incluido el blanco.
12. Tapar e incubar 20 minutos en la oscuridad.
13. Pipetear 100 uL de solución de parada incluido el blanco.
14. Medir la absorción a 450 o a 620 nm. El color es estable durante 60 minutos.
Medición:
Efectuar con e blanco del pocillo A1 la calibración de 0 con el lector de ELISA.
Medir la absorbancia de todos los pocillos a 450 mm.
Anotar los resultados de los controles y de la muestra.
Si la calibración a 0 no es posible automáticamente restar el valor del pocillo blanco al resto.
Calculo del valor de la medicion:
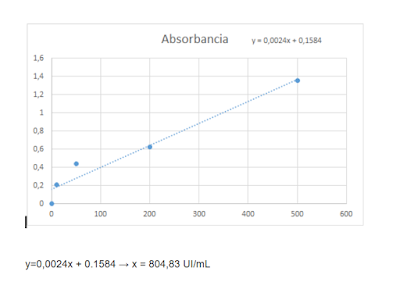
Para obtener resultados cuantitativos en UI/mL se realiza una curva de calibración con las absorbancias en el eje y la concentración de los calibradores en el eje x. Luego por extrapolación podemos obtener la concentración de la muestra. En nuestro caso la realizamos en excell donde también se obtiene una fórmula de la gráfica y de ahí se obtiene la concentración de la muestra aunque también lo hicimos extrapolando.
La concentración de la muestra es 804,83 UI/mL
2. Se prepara pocillos para calibradores.
3. Pocillos para las muestras.
4. Pipetear 100 µL en cada pocillo de calibradores. Se deja el primer pocillo vacío para el blanco del sustrato
5. Pipetear 100 µL de muestra diluida en el pocillo 7. Previamente se diluyó la muestra al 1/10
6. Tapar e incubar 1 hora a temperatura ambiente.
7. Tras incubar aspirar o volcar el líquido de la tira y lavalos 3 veces con 300 uL de solución de lavado.
NOTA: es la fase más importante de la técnica porque un mal lavado da falsos positivos. Evitar rebosar los pocillos. Al acabar darle unos golpes en el papel absorbente.
8. Pipetear 100 uL de conjugado anti IgG con excepción del blanco.
9. Tapar e incubar 30 minutos a temperatura ambiente.
10. Repetir paso 7.
11. Pipetear 100 uL de sustrato en todos los pocillos incluido el blanco.
12. Tapar e incubar 20 minutos en la oscuridad.
13. Pipetear 100 uL de solución de parada incluido el blanco.
14. Medir la absorción a 450 o a 620 nm. El color es estable durante 60 minutos.
Medición:
Efectuar con e blanco del pocillo A1 la calibración de 0 con el lector de ELISA.
Medir la absorbancia de todos los pocillos a 450 mm.
Anotar los resultados de los controles y de la muestra.
Si la calibración a 0 no es posible automáticamente restar el valor del pocillo blanco al resto.
Calculo del valor de la medicion:
Para obtener resultados cuantitativos en UI/mL se realiza una curva de calibración con las absorbancias en el eje y la concentración de los calibradores en el eje x. Luego por extrapolación podemos obtener la concentración de la muestra. En nuestro caso la realizamos en excell donde también se obtiene una fórmula de la gráfica y de ahí se obtiene la concentración de la muestra aunque también lo hicimos extrapolando.
La concentración de la muestra es 804,83 UI/mL



















Comentarios
Publicar un comentario